Source: http://www.tulane.edu/~wiser/malaria/cmb.html
Членовите на Plasmodium родот се еукариотски микроби. Затоа, мобилен и молекуларна биологија на Plasmodium ќе биде сличен на други еукариоти. Единствена функција на паразитот на маларијата е неговата интрацелуларен начин на живот. Поради интрацелуларен нејзината локација паразитот има близок однос со својот домаќин клетка која што може да се опише на клеточно и молекуларно ниво. Особено, паразит мора да влезе во клетката-домаќин, и еднаш внатре, ја менува клетката домаќин. Молекуларна и клеточна биологија на домаќин-паразит интеракции кои се вклучени во овие два процеси ќе се дискутира.
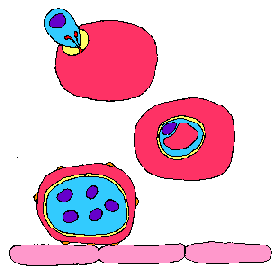 Содржина:
Содржина:
*Домаќинот на еритроцитите инвазија
Почетна обврзувачки и MSP-1
Пренасочување и секреторни органели
Junction Формирање и Microneme Протеини
паразит Влегување
Плови подвижност и Glidosome
резиме
*Домаќинот на еритроцитите Измена
Копчиња и Cytoadherence
Ендотелните клеточни рецептори
антигенски варијации
резиме
*референци
ДОМАЌИН клеточната инвазија
Паразитите на маларија се членови на Apicomplexa. Apicomplexa се карактеризираат со збир на органели се наоѓаат во некои фази на животниот циклус на паразитот. Овие органели, колективно познати како апикална органели, бидејќи на нивната локализација на едниот крај на паразитот, се вклучени во интеракцијата меѓу паразит и домаќин. Особено, апикална органели се вмешани во процесот на клетката на домаќинот инвазија. Во случај на Plasmodium, се идентификувани три различни инвазивни форми: sporozoite, merozoite и ookinete (види Plasmodium Животот циклус). Следниве дискусија се фокусира на клеточна биологија на мерозоити и еритроцитите инвазија. Референци на други Apicomplexa и Plasmodium спорозоити ќе бидат направени за да се илустрира заеднички карактеристики.
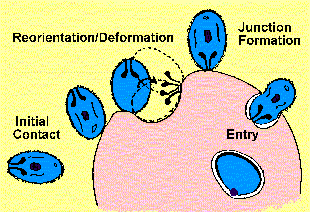 Merozoites брзо (околу 20 секунди), а особено внесете еритроцитите. Оваа специфичност се манифестира како за еритроцитите како префериран тип на клетка-домаќин и за одреден вид домаќин, имплицирајќи рецептор-лиганд интеракции. Инвазија на еритроцитите е сложен процес кој е само делумно разбрани на молекуларно и клеточно ниво. Сепак, постигнат е значителен напредок во идентификување на многу од паразити и домаќин на протеини кои се важни за процесот на инвазијата.
Merozoites брзо (околу 20 секунди), а особено внесете еритроцитите. Оваа специфичност се манифестира како за еритроцитите како префериран тип на клетка-домаќин и за одреден вид домаќин, имплицирајќи рецептор-лиганд интеракции. Инвазија на еритроцитите е сложен процес кој е само делумно разбрани на молекуларно и клеточно ниво. Сепак, постигнат е значителен напредок во идентификување на многу од паразити и домаќин на протеини кои се важни за процесот на инвазијата.
Четири различни чекори (Gratzer и Dluzewski 1993) во процесот на инвазијата може да се препознае (Слика):
1.почетна обврзувачки merozoite
2.пренасочување и еритроцитите деформација
3.формирање крстосница
4.влез паразит
Merozoite површински протеини и домаќин-паразит интеракции
Почетната интеракцијата помеѓу merozoite и на еритроцитите е веројатно случајна судир и се претпоставува дека вклучува реверзибилна интеракции помеѓу протеини на површината на merozoite и еритроцитите домаќин. Неколку merozoite протеини површина се опишани. Најдобар карактеризира е merozoite површински протеин-1 (MSP-1). Посредни докази имплицирајќи MSP-1 во еритроцитите инвазија вклучува униформа нивното распоредување на површината на merozoite и на забелешката дека антитела против MSP-1 запираат инвазијата (Носител 1994). Покрај тоа, MSP-1does се поврзе со појас 3 (Гоел 2003). Сепак, улогата на MSP-1 во инвазија не е дефинитивно докажано. Слично на тоа, circumsporozoite протеини (CSP) веројатно игра улога во насочување на спорозоите на хепатоцитите преку интеракција со хепарин сулфат протеогликани (Sinnis и Некој 1997).
Друг интересен аспект на MSP-1 е обработка на протеолитички што се совпаѓа со merozoite созревање и инвазија (Cooper 1993). А примарна преработка се случува во времето на merozite созревање и резултира со формирање на неколку полипептиди се држат заедно во не-ковалентна комплекс. А во средно обработка се случува во исто време со merozoite инвазија на локација во близина на C-терминалот. На не-ковалентна комплекс на MSP-1 полипептид фрагменти се фрли од површината на merozoite следните протеолиза, а само мал C-терминален фрагмент е и во еритроцитите. Оваа загуба на комплекс MSP-1 може да се поврзе со загубата на “нејасни” униформа за време merozoite инвазија. C-терминален фрагмент е спроведен до површината на merozoite од страна на сидро GPI и се состои од два EGF-како модули. EGF како модули се наоѓаат во различни протеини и обично се вмешани во протеини-протеински интеракции. Една можност е дека средното протеолитички функции за обработка да се изложи на модули EGF како со кои се зајакнува интеракции помеѓу merozoite и еритроцитите. Важноста на MSP-1 и неговата обработка се подразбира од следниве забелешки:
*вакцинација со модули EGF како може да се заштити против маларија и
*инхибиција на блокови за обработка на протеолитички merozoite инвазија.
Точната улога (и) која MSP-1 и неговата игра обработка во процесот на инвазијата merozoite не се познати. Други протеини merozoite површина, исто така, се вклучени во interation на merozoite со еритроцити (разгледани кравар 2012).
Пренасочување и секреторни органели
 По врзување за еритроцитите, паразитот се свртува така што “апикална крајот” на паразитот поставени на еритроцитната мембрана. Ова merozoite пренасочување, исто така, се совпаѓа со преодна еритроцитите деформација. Апикалната мембрана антиген-1 (АМА-1) е вмешан во ова пренасочување (Мичел 2004). AMA-1 е трансмембрански протеин локализирана во апикална крајот на merozoite и се врзува еритроцити. Антитела против АМА-1 не interfer со првичниот контакт помеѓу merozoite и еритроцитите што сугерира дека АМА-1 не е вклучена во merozoite attachement. Но, антитела против АМА-1 спречи пренасочување на merozoite и со тоа да го блокира merozoite инвазија.
По врзување за еритроцитите, паразитот се свртува така што “апикална крајот” на паразитот поставени на еритроцитната мембрана. Ова merozoite пренасочување, исто така, се совпаѓа со преодна еритроцитите деформација. Апикалната мембрана антиген-1 (АМА-1) е вмешан во ова пренасочување (Мичел 2004). AMA-1 е трансмембрански протеин локализирана во апикална крајот на merozoite и се врзува еритроцити. Антитела против АМА-1 не interfer со првичниот контакт помеѓу merozoite и еритроцитите што сугерира дека АМА-1 не е вклучена во merozoite attachement. Но, антитела против АМА-1 спречи пренасочување на merozoite и со тоа да го блокира merozoite инвазија.
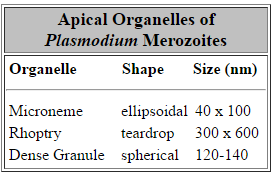
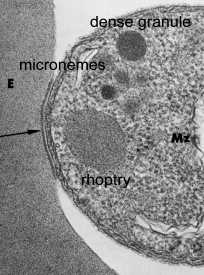
Специјализирани секреторни органели се наоѓаат на апикална крајот на инвазивни фази на apicomplexan паразити. Три морфолошки различни апикална органели се откриени со помош на електронска микроскопија: micronemes, rhoptries и густи гранули (Табела). Густите гранули не секогаш се вклучени со апикална органели и веројатно ја претставуваат хетерогено население на секреторен везикули.
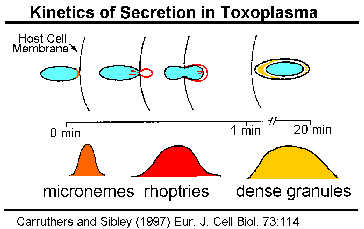 Кинетика на SecretionThe содржината на апикална органели да бидат протерани, како паразит инвазија, со што се укажува на тоа дека овие органели играат некоја улога во инвазија. Експериментите во Toxoplasma gondii укажуваат на тоа дека micronemes да бидат протерани, прво и да се случи со првичниот контакт меѓу паразит и домаќин (Carruthers и Sibley 1997). Зголемување на цитоплазматски концентрација на калциум е поврзан со microneme празнење и, најверојатно, вклучува патека сигнал вклучуваат фосфолипаза C, inositoltriphosphate и калциум зависната протеин киназа (Шарма и Chitnis 2013).
Кинетика на SecretionThe содржината на апикална органели да бидат протерани, како паразит инвазија, со што се укажува на тоа дека овие органели играат некоја улога во инвазија. Експериментите во Toxoplasma gondii укажуваат на тоа дека micronemes да бидат протерани, прво и да се случи со првичниот контакт меѓу паразит и домаќин (Carruthers и Sibley 1997). Зголемување на цитоплазматски концентрација на калциум е поврзан со microneme празнење и, најверојатно, вклучува патека сигнал вклучуваат фосфолипаза C, inositoltriphosphate и калциум зависната протеин киназа (Шарма и Chitnis 2013).
На rhoptries се испуштаат веднаш по micronemes и ослободување на нивната содржина во корелација со формирањето на parasitophorous вакуоли.
Густа содржина гранули се ослободени, откако паразит има завршено неговото влегување, и според тоа, обично се причина за измена на клетката на домаќинот. Сепак, subtilisin како протеаза, кои се вклучени во средното протеолитички обработка на MSP-1 (дискутиран погоре), исто така е локализиран на Plasmodium густи гранули (Blackman 1998 година, Barale 1999). Ако MSP-1 обработка е катализирана од овие протеази, тогаш барем некои густи гранули мора да биде разрешен во времето на инвазијата.
Специфични интеракции и разводна Формирање
По merozoite пренасочување и microneme празнење на раскрсницата помеѓу форми на паразити и клетката домаќин. Веројатно, microneme протеини се важни за формирање на раскрсницата. Протеини локализирани на micromenes вклучуваат:
*ЕБА-175, 175 kDa “еритроцитите обврзувачки антиген” од P. falciparum
*ДКП, Дафи-врзувачки протеин од P. vivax и P. knowlesi
*SSP2, Plasmodium sporozoite површински протеин-2. Исто така познат како замка (тромбоспондин поврзани со лепило протеини).
*Протеини со хомологија со SSP2 / стапица од Toxoplasma (MIC2), Eimeria (Etp100), и Cryptosporidium
*CTRP, circumsporozoite- и стапица поврзани со протеини од Plasmodium се наоѓаат во фаза на ookinete
 Од особено белешка е ЕБА-175 и ДКП на кои се евидентираат остатоци сиалинска киселина на glycophorins и антигенот Дафи, соодветно (Табела). Со други зборови, овие протеини се паразит најверојатно се вклучени во рецептор-лиганд интеракции со протеини кои се изложени на површината на еритроцитите. Нарушување на ЕБА-175 генот резултира со паразитот префрлување од киселина зависни од патеката на сијалинската на киселина, независна патека сиалична (Рид 2000), што покажува дека има некои вишок во однос на интеракциите на рецептор-лиганд.
Од особено белешка е ЕБА-175 и ДКП на кои се евидентираат остатоци сиалинска киселина на glycophorins и антигенот Дафи, соодветно (Табела). Со други зборови, овие протеини се паразит најверојатно се вклучени во рецептор-лиганд интеракции со протеини кои се изложени на површината на еритроцитите. Нарушување на ЕБА-175 генот резултира со паразитот префрлување од киселина зависни од патеката на сијалинската на киселина, независна патека сиалична (Рид 2000), што покажува дека има некои вишок во однос на интеракциите на рецептор-лиганд.
Споредба на секвенци на ЕБА-175 и ДКП открие конзервирани структурни карактеристики. Тие вклучуваат трансмембрански домени и рецептор-врзувачкиот домени (слика, модифицирани од Адамс 1992). активноста на рецептор-врзувачкиот е одбележан на домен во кој цистеин и ароматични амино киселински остатоци се конзервирани помеѓу видовите (сино на слика). Овој наводен врзувачки домен се удвои во ЕБА-175. Топографијата на домен трансмембранскиот е во согласност со паразит на лиганди се интегрален мембрански протеини со рецептор-врзувачкиот домен изложени на површината на merozoite следните microneme исцедок.
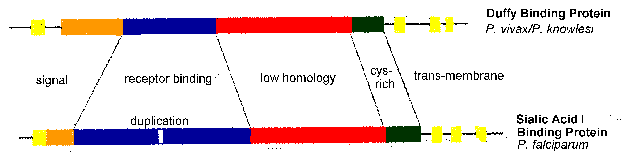
Junction Формирање Microneme за медиумите
Стрелка означува електрони густа раскрсницата помеѓу merozoite и еритроцитите. Микрограф од Aikawa et al (1978) Ј Мобилен Biol. 77:72.
 ЕБА-175 и ДКП се дел од семејството на адхезини најде во паразитите на маларија обично се нарекува EBL за eyrthrocyte-обврзувачки слично. Друго семејство на адхезини вклучени во врзувањето на мерозоити да erthrocytes се на ретикулоцити-обврзувачки како колеги (Rh). Овие различни адхезини се поврзе со различни рецептори на еритроцитите и да се обезбеди вишок во способноста на merozoite за формирање на раскрсницата со еритроцити (Tham 2012). рецептор basigin може да биде од суштинско значење за инвазијата на P. falciparum (Crosnier 2011).
ЕБА-175 и ДКП се дел од семејството на адхезини најде во паразитите на маларија обично се нарекува EBL за eyrthrocyte-обврзувачки слично. Друго семејство на адхезини вклучени во врзувањето на мерозоити да erthrocytes се на ретикулоцити-обврзувачки како колеги (Rh). Овие различни адхезини се поврзе со различни рецептори на еритроцитите и да се обезбеди вишок во способноста на merozoite за формирање на раскрсницата со еритроцити (Tham 2012). рецептор basigin може да биде од суштинско значење за инвазијата на P. falciparum (Crosnier 2011).
Други microneme протеини во семејството “стапица”, исто така, е вмешан во локомотивата и / или мобилен инвазија на фазата на sporozoite и други apicomplexa (Tomley и Soldati 2001). Сите овие протеини (EBL, Rh, стапица семејства) имаат домени кои се претпоставува дека се вклучени во клетка-клетка адхезија, како и транс-мембрана домени на нивните C-терминалите. ослободување Microneme ќе се изложуваат на лепило домени, кои потоа ќе се врзуваат за рецепторите на клетката на домаќинот и на тој начин се формира спој помеѓу инвазивна форма (на пример, merozoite) и на клетката на домаќинот (Слика).
Друг елемент на овој куп вклучува протеини се најде во вратот на rhopthry, особено RON2. RON2 е ослободување од rhoptry и вметнува во мембраната на еритроцитите. тогаш RON2 се врзува за AMA-1 која е локализирана на површината на merozoite (Tonkin 2011). RON2 / АМА-1 комплекс потоа, исто така придонесува за оваа цврста раскрсницата формиран помеѓу merozoite и еритроцитите. Фосфорилација на АМА-1 исто така може да бидат вклучени во влез паразит (Leykauf 2010).
Во краток преглед:
*електрон-густи куп форми помеѓу апикална крајот на merozoite и домаќин на мембраната на еритроцитите веднаш по пренасочување
*тесни формирање куп и ослободување microneme се случи во исто време
*протеини локализирани на micronemes врзуваат за рецепторите на површината на еритроцитите
*протеини во вратот на rhoptry се вметнуваат во мембраната домаќин и се врзуваат за АМА-1 на merozite површината за да формираат тесни крстосница
Овие набљудувања покажуваат дека на раскрсницата претставува силна врска меѓу еритроцитите и merozoite која е посредувана од рецептор-лиганд интеракции. формирање спој може да поведе microneme празнење проследено со ослободување на вратот протеини rhoptry кој изложува на рецептор-врзувачкиот домени на паразит лиганди. Овој механизам за поведување на тесни домаќин-паразит интеракцијата е слична и во други инвазивни фази на apicomplexan паразити.
Паразит Влегување
Apicomplexan паразити активно ги нападне клетките на домаќинот и влез не се должи на навлегувањето и фагоцитоза на клетката на домаќинот. Ова е особено евидентна во случај на еритроцитите која нема способност фагоцитни. Исто така, на еритроцитите мембрана има 2-димензионална submembrane цитоскелет кој исклучува ендоцитоза. Затоа, поттик за формирање на parasitophorous вакуола мора да дојде од паразит. Неколку настани ќе се случат при влегување паразит и тоа: 1) нарушување на submembrane на цитоскелетонот на еритроцити, 2) формирање на parasitophorous вакуола, и 3) и пролевање на merozoite површински протеини. Паразит влез е управувано од страна на ACTO-миозин моторен комплекс наречен glidosome.
Еритроцитите мембрански протеини се дистрибуира во времето на формирање на една крстосница, така што областите за контакт е бесплатно на еритроцитната мембрана. А merozoite серин протеаза кои се прилепува на еритроцитите бенд 3 е опишан (Браун бретонски 1993). Поради клучна улога бенд 3 игра во homeostatis на скелет submembrane, неговата деградација може да резултира со локализирано нарушување на цитоскелетот. Реорганизација на цитоскелетот на submembrane и липидите архитектура веројатно придружува merozoite инвазија (Zuccala 2011).
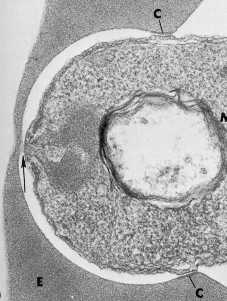
Никулецот parasitophorous вакуолна мембрана (PVM) форми во областа на раскрсницата. Оваа мембрана инвагинација, најверојатно, добиени од двете мембрана домаќинот и паразитот компоненти и се шири како паразит влегува во еритроцитите. Врски помеѓу rhoptries и зародиш PVM понекогаш се забележани (слика, стрелка). Покрај тоа, содржината на rhoptries често се ламеларна (на пример, слоевитоста) мембрани и некои rhoptry протеини се локализирани на PVM по инвазијата, што укажува дека rhoptries исто така, функционира во формирањето PVM (Сем-Yellowe 1996).
Ookinetes немаат rhoptries и не формираат parasitophorous вакуоли во епителните клетки на комарец midgut. На ookinetes брзо поминуваат низ епителните клетки и да предизвика голема штета, како што се приближуваат кон базалната ламина (Хан 2000 година, Ziegler 2000). Слично на тоа, спорозоите може да влезе и излез хепатоцити без подложени exoerythrocytic schizogony. Оние паразити кои не подлежат на schizogony се слободни во цитоплазмата домаќин, додека оние кои се подложени schizogony кои се затворени во PVM (Mota 2001). Овие набљудувања покажуваат дека е потребно PVM за интрацелуларно развој и не е неопходно за процесот на клетката на домаќинот инвазија. Како што е формирана во зародиш parasitophorous вакуола, на раскрсницата (означена со C во слика) помеѓу паразит и домаќин станува прстенеста и паразитот се чини дека се движат низ овој анулус како Микрограф од Aikawa et al што влегува во проширување parasitophorous вакуоли. Наместо тоа се движи раскрсницата се повлечат од фронтот на паразитот на задните резултира со (1978) Ј Мобилен Biol. 77:72 движење напред на паразитот во клетката домаќин.
Како влегува во паразит, MSP-1 голем број на протеини merozoite површина се фрли. Овој процес пролевање е со посредство на специфични протеази и е подредена процес (Бојл 2014).
На Glideosome
Инвазивни форми на паразити apicomplexan често се подвижни форми кои што ползи по должината на супстрат од еден вид на подвижност се нарекува “плови подвижност. Плови подвижност, како инвазија, исто така, вклучува ослободување на micronemal адхезини, приврзаност кон супстрат, како и ограничување на адхезини на задниот крај на zoite. Една разлика меѓу плови мотилитет и инвазија е дека micronemes мора постојано да се објави како организмот се движи. Така, плови подвижност не се однесуваат на оваа релативно мала движат спој, но континуиран формирањето на нови споеви помеѓу zoite и супстрат. Покрај тоа, адхезини се расцепуваат од површината на zoite како ниеден стигнат до задниот на zoite и сенка на лепило молекули се остави зад себе движат zoite на слој. Механизмот на подвижност и инвазијата се многу слични и на тој начин, за време на инвазијата на паразитот буквално индексира во клетката домаќин преку движат спој. Покрај тоа, некои apicomplexans користат овој тип на мотилитетот да избега од клетки и може да напречни биолошки бариери со внесување и изнесување клетки.
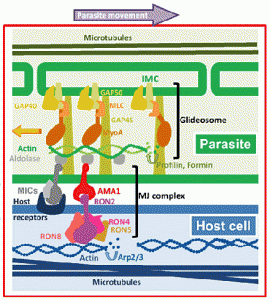 Модел на движење раскрсницата комплекс и glidesome возење плови подвижност од Besteiro (2011).
Модел на движење раскрсницата комплекс и glidesome возење плови подвижност од Besteiro (2011).
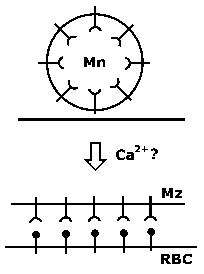
Cytochalasins инхибираат влез merozoite, но не и приврзаност, со што се укажува на тоа дека е потребно на сила за паразит инвазија и плови подвижност е врз основа на актин-миозин цитоскелетна елементи. Способноста на миозин, моторно протеини, за да генерирате сила е добро позната (на пр., Мускулната контракција). А миозин уникатен на Apicomplexa е идентификуван и е укотвен во мембраната сложени внатрешниот (МОС). За меѓуопштинска соработка се однесува на двојно мембрана лежи под плазма мембрана на инвазивни фази на Apicomplexan паразити. Ова меѓуопштинска соработка е дополнително поддржан од страна на под-pellicular микротубули кои работат на должината на паразитот. За меѓуопштинска соработка поврзани миозин поврзува со actin, како дел од glidesome. Различните адхезини (на пример, EBL, Rh, стапица и АМА-1), кои го сочинуваат движат раскрсницата комплекс (МЈ) потоа се поврзани со glidesome (Слика).
Членови на семејството стапицата и други адхезини имаат конзервирани цитоплазматски домен. Ова цитоплазматски домен е поврзан со краток актин нишки преку алдолаза. нишки actin и myosin се ориентираат во просторот помеѓу внатрешната мембрана комплекс и плазма мембрана, така што на миозин движи на актин нишки кон задниот дел на zoite. На myosin е укотвен во облик на меѓуопштинска соработка не се движи. Затоа, адхезини трансмембранскиот се влечат низ течност липидниот двослој на плазма мембрана поради нивната поврзаност со нишки на актин. Така комплексот на адхезини и актин нишки се транспортира кон задниот дел на клетката. Од адхезини се или комплекс со рецептори на клетката на домаќинот и закотвени на цитоскелетонот на клетката домаќин, или врзани за супстрат, крајниот резултат е движење напред на паразитот (Слика). Кога адхезини стигнат до задниот крај на паразитот се proteolyitcally разложува и барака од zoite површина.
Во случај на клеточната инвазија клеточната мембрана PVM и домаќини ќе треба да се затворени, така што PVM е недопрена и околните паразитот и плазма домаќин мембрана е исто така непроменети. Механизмите кои се вклучени во овој последен чекор на инвазијата не се познати.
Резиме
Merozoite инвазија е сложен и нареди процес. Некаков модел на merozoite инвазија вклучува:
Почетна merozoite обврзувачки вклучува реверзибилна интеракции помеѓу протеини merozoite површина и домаќин erythrocyte.The точните улоги на MSP1 и други merozoite површински протеини не се познати.
Пренасочување од страна на непознат резултати механизам во апикална крајот на merozoite се поставени на еритроцитната мембрана.
Испуштање на micronemes се совпаѓа со формирање на тесна спој помеѓу домаќинот и паразитот. Тесната раскрсницата е посредувана од рецептор-лиганд интеракции помеѓу протеини еритроцитите површина и intergral паразит мембрана изложени од страна microneme исцедок.
Локализиран расчистување на цитоскелетонот на еритроцитите submembrane и формирање на почетна parasitophorous вакуоли. формирање PVM е во корелација со испуштање на rhoptries.
Движење на merozoite преку тесна крстосница во облик на прстен формирана од страна на рецептор / лиганд комплекс. На сила е генерирана од миозин мотори поврзани со транс-мембрана паразит лиганди се движат по актин нишки во рамките на паразит.
Затворање на PVM и мембраната на еритроцитите.
Многу протеини кои се вклучени во процесот на инвазијата се идентификувани. Ова исто така ќе вклучува сигнализација настани меѓу разните чекори од инвазијата (Сантос и Soldati-Favre 2011). Сепак, останува уште многу да се научи за клеточна и молекуларна биологија на merozoite инвазија. А подобро разбирање на сложениот процес на паразит инвазијата може да доведе до развој на нови терапевтски пристапи кон маларија и други болести предизвикани од Apicomplexans.
Домаќин на еритроцитите МОДИФИКАЦИЈА
Откако во внатрешноста на еритроцитите, паразитот се подложува на трофични фаза проследено со репликациски фаза. Во текот на овој период intraerythrocytic, паразитот модифицира домаќин на тоа посоодветно живеалиште направи. На пример, на еритроцитната мембрана станува се повеќе порозни на мали метаболити молекуларна тежина, веројатно како одраз на потребите на активно расте паразит (види апсорпција и пропустливост).
Друга промена на клетка-домаќин се однесува на cytoadherence на P. falciparum инфицираните еритроцити за ендотелните клетки и како резултат на секвестрација на зрели паразити во капиларите и пост-капиларен венули. Ова секвестрација најверојатно, води до microcirculatory измени и метаболни пореметувања кои би можеле да бидат одговорни за голем број на манифестации на тешка фалципарум маларија (види патогенезата). На cytoadherence за ендотелните клетки дава најмалку две предности за паразит: 1) микроаерофилни средина која е се подобро прилагодени за паразит метаболизмот, и 2) избегнување на слезината и последователно уништување.
Копчиња и Cytoadherence
Една од главните структурни промена на еритроцитите домаќин се електронски густи изданија, или “копчиња”, на мембраната на еритроцитите на P. falciparum-инфицираните клетки. Со копчиња се предизвикани од паразити и неколку паразит протеини се поврзани со рачки (Deitsch и Wellems 1996). Две протеини кои би можеле да учествуваат во формирањето на копчето или да влијае домаќин на еритроцитите submembrane цитоскелетонот и индиректно предизвика формирање копчето се богати на копчето-поврзани хистидин протеини (KAHRP) и мембраната на еритроцитите протеин-2 (PfEMP2), исто така, повика MESA. Ниту KAHRP ниту PfEMP2 се изложени на надворешната површина на еритроцити, но се локализирани на цитоплазматски лицето на мембраната домаќин (Слика). Точниот нивната улога во формирањето на копчето не се познати, но може да вклучуваат реорганизација на submembrane цитоскелетот.
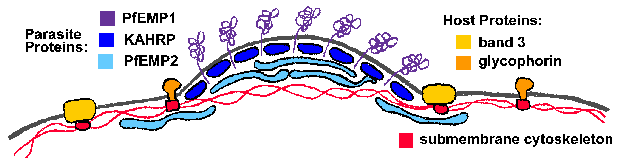
Со копчиња се смета дека играат улога во секвестрација на заразените еритроцити, бидејќи тие се точки на контакт меѓу заразените еритроцити и васкуларните ендотелни клетки и паразит видови кои изразуваат копчиња покажуваат највисоко ниво на секвестрација. Покрај тоа, нарушување на KAHRP резултира со губење на копчињата и на способноста да се cytoadhere во услови на проток (Краб 1997). А полиморфни протеин, наречен PfEMP1, исто така, е локализиран на копчиња и е изложен на површината на домаќинот еритроцитите. Транслокација на PfEMP1 на површината на еритроцитите делумно зависи од друг мембраната на еритроцитите поврзани протеин наречен PfEMP3 (Waterkeyn 2000). PfEMP1 веројатно функционира како лиганд кој се врзува за рецепторите на домаќин ендотелијалните клетки. Други предложени cytoadherence лиганди вклучуваат изменета бенд 3, наречен pfalhesin (Шерман 1995), sequestrin, rifins и clag9 (Крег и Scherf 2001).
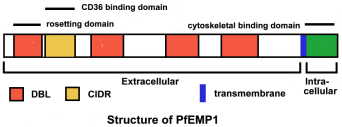 Секој паразит има околу 40-60 var гени кои покажуваат висок степен на варијабилност, но имаат слични целокупната структура (Слика). PfEMP1 има голем екстрацелуларниот N-терминалот на домен, регион трансмембрански и C-терминалот интрацелуларен домен. регион C-терминал е конзервиран меѓу членовите на семејството на var и се верува дека се зацврсти PfEMP1 да цитоскелетонот на еритроцитите submembrane. Особено, овој кисела C-терминал на домен може да комуницирате со основните KAHRP на копчето (Waller 1999), како и на спектрин и актин (О, 2000). var genePfEMP1 е член на var ген семејство (Hviid 2015)
Секој паразит има околу 40-60 var гени кои покажуваат висок степен на варијабилност, но имаат слични целокупната структура (Слика). PfEMP1 има голем екстрацелуларниот N-терминалот на домен, регион трансмембрански и C-терминалот интрацелуларен домен. регион C-терминал е конзервиран меѓу членовите на семејството на var и се верува дека се зацврсти PfEMP1 да цитоскелетонот на еритроцитите submembrane. Особено, овој кисела C-терминал на домен може да комуницирате со основните KAHRP на копчето (Waller 1999), како и на спектрин и актин (О, 2000). var genePfEMP1 е член на var ген семејство (Hviid 2015)
Екстрацелуларниот домен се карактеризира со 1-5 копии на Дафи-обврзувачки како (DBL) домени. DBL овие домени се слични на рецептор обврзувачки регионот на лигандите се вклучени во merozoite инвазија (дискутиран погоре) на. DBL домени изложба на конзервирани растојание од цистеин и хидрофобни остатоци, но инаку покажуваат малку хомологија. Филогенетска анализа покажува дека постојат пет различни класи (означени како А, Б, Г, Д и Е) на DBL домени (Hviid 2015). Првиот DBL е секогаш ист тип (назначено) и ова е проследено со interdomain регионот богати со цистеин (CIDR). Променлив број на DBL во различни наредби сочинуваат остатокот од екстрацелуларниот домен на PfEMP-1.
За време на секоја митотична циклус гени var подложат рекомбинација води кон континуирано обезбедување на дополнителни варијанти (Claessens 2014). Интересно, структурата на генот семејството на var е присутна уште од пред P. falciparum и P. reichenowi дивергенција на што се случи пред повеќе од два милиони години (Zilversmit 2013).
Ендотелните клеточни рецептори
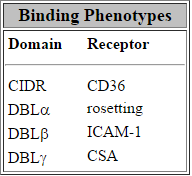
 Неколку можни ендотелните рецептори (кутија) се идентификувани од страна на тестирање на способноста на заразени еритроцити да се поврзе во анализите статички придржување (Beeson и Браун 2002). Еден од најдобрите карактеризира меѓу нив е CD36, 88 kDa интегрален мембрански наоѓаат на моноцитите, тромбоцити и ендотелни клетки протеини. Заразени еритроцити од повеќето паразит изолати се врзуваат за CD36 и обврзувачки доменот е одбележан на CIDR на PfEMP1 (види слика). Сепак, CD36 не е регистриран на ендотелните клетки на церебралните крвни садови и паразити од клиничките изолати имаат тенденција да се придржуваат и CD36 и интрацелуларен лепливоста молекула-1 (ICAM1). ICAM1 е член на суперфамилијата имуноглобулин и функции во клетка-клетка адхезија. Покрај тоа, секвестрација на заразените еритроцити и ICAM1 изразување е ко-локализиран во мозокот (Turner 1994).
Неколку можни ендотелните рецептори (кутија) се идентификувани од страна на тестирање на способноста на заразени еритроцити да се поврзе во анализите статички придржување (Beeson и Браун 2002). Еден од најдобрите карактеризира меѓу нив е CD36, 88 kDa интегрален мембрански наоѓаат на моноцитите, тромбоцити и ендотелни клетки протеини. Заразени еритроцити од повеќето паразит изолати се врзуваат за CD36 и обврзувачки доменот е одбележан на CIDR на PfEMP1 (види слика). Сепак, CD36 не е регистриран на ендотелните клетки на церебралните крвни садови и паразити од клиничките изолати имаат тенденција да се придржуваат и CD36 и интрацелуларен лепливоста молекула-1 (ICAM1). ICAM1 е член на суперфамилијата имуноглобулин и функции во клетка-клетка адхезија. Покрај тоа, секвестрација на заразените еритроцити и ICAM1 изразување е ко-локализиран во мозокот (Turner 1994).
Хондроитин сулфат А (АДС) е вмешан во cytoadherence во рамките на плацентата и може да придонесе за негативни влијанија на P. falciparum време на бременоста. Улогата на некои од другите потенцијални рецептори не е јасно. На пример, придржување до тромбоспондин покажува низок афинитет и не може да поддржува обврзувачки во услови на проток. Врзување на VCAM1, PECAM1 и Е-селектин е многу ретко и прашања во врска со својот конститутивен израз на ендотелните клетки се зголеми. Сепак, cytoadherence може да вклучи повеќе интеракции рецептор / лиганд.
 Rosetting е уште еден феномен лепило изложени од страна на P. falciparum инфицирани еритроцитите. Заразени еритроцити од некои паразитски изолати ќе се поврзе mutiple незаразени еритроцити и PfEMP1 се чини дека имаат улога во барем некои rosetting. Можни рецептори вклучуваат комплемент рецептор-1 (CR1), крвна група А антиген, или гликозаминогликан половини на неидентификуван протеогликанот. (Види слика со ликот можно рецептор-лиганд интеракции кои се вклучени во rosetting на друга веб страница.)
Rosetting е уште еден феномен лепило изложени од страна на P. falciparum инфицирани еритроцитите. Заразени еритроцити од некои паразитски изолати ќе се поврзе mutiple незаразени еритроцити и PfEMP1 се чини дека имаат улога во барем некои rosetting. Можни рецептори вклучуваат комплемент рецептор-1 (CR1), крвна група А антиген, или гликозаминогликан половини на неидентификуван протеогликанот. (Види слика со ликот можно рецептор-лиганд интеракции кои се вклучени во rosetting на друга веб страница.)
На различни видови на DBL домени и CIDR (дискутиран погоре) се врзуваат за различни ендотелните клетки рецептори (Крег и Scherf 2001). На пример, DBLa, која се состои од првите домен, се врзува со голем број на рецептори поврзани со rosetting. Врзувањето на CIDR да CD36 може да се смета за богатството на овој обврзувачки фенотип меѓу паразит изолати.
Антигенски варијации
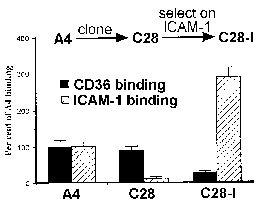 Робертс et al 1992The кодирање на cytoadherence лиганд од страна на високо полиморфни гени семејството претставува парадокс во тој рецептор / лиганд интеракции се сметаат за многу специфична. Интересно, за избор на различни фенотипови cytoadherent резултира со Придружните промена во типот на површината антигенски (Бигс 1992). Слично на тоа, испитување на клонална паразит линии откри дека промените во вид на површината антигенски корелација со разлики во врзувањето на CD36 и ICAM1. На пример, на родителска линија (A4) се почитуваат подеднакво добро да CD36 и ICAM1, додека еден од А4 добиени клонови (C28) изложени значително предност за CD36 (слика, модифицирани од Робертс 1992). Врзување на ICAM1 потоа се одбере повторно со поместување на инфицираните еритроцити на ICAM1. Сите три паразит клонови (A4, C28, C28-I) изложени различни антигенски типови како што е докажано од страна на аглутинација со хипер-имуни серуми.
Робертс et al 1992The кодирање на cytoadherence лиганд од страна на високо полиморфни гени семејството претставува парадокс во тој рецептор / лиганд интеракции се сметаат за многу специфична. Интересно, за избор на различни фенотипови cytoadherent резултира со Придружните промена во типот на површината антигенски (Бигс 1992). Слично на тоа, испитување на клонална паразит линии откри дека промените во вид на површината антигенски корелација со разлики во врзувањето на CD36 и ICAM1. На пример, на родителска линија (A4) се почитуваат подеднакво добро да CD36 и ICAM1, додека еден од А4 добиени клонови (C28) изложени значително предност за CD36 (слика, модифицирани од Робертс 1992). Врзување на ICAM1 потоа се одбере повторно со поместување на инфицираните еритроцити на ICAM1. Сите три паразит клонови (A4, C28, C28-I) изложени различни антигенски типови како што е докажано од страна на аглутинација со хипер-имуни серуми.
Изразот на одредена PfEMP1 ќе резултира со паразит со посебен cytoadherent фенотип и ова исто така може да влијае на патогенезата и болест исход. На пример, им на ICAM-1 обично се вмешани во церебралната патологија. Затоа, паразити изразувајќи PfEMP1 кој се врзува за ICAM1 може да биде поголема веројатност да предизвика церебрална маларија. Всушност, повисоко ниво на транскрипција на одредени var гени се наоѓаат во случаи на тешка маларија во споредба со некомплицирана маларија (Rottmann 2006). Слично на тоа, поголем процент на изолати кои се врзуваат до АДС се добиени од плацентата во однос на периферната циркулација на било бремени жени или деца (Слика, модифицирани од Beeson 1999). Покрај тоа, плацентата маларија често е поврзана со повисоко ниво на транскрипција на одредена var ген кој го поврзува АДС (Дафи 2006). Овој феномен не е ограничена на плацентата во кои има една доминантна изразување на одредени var гени во различни ткива (слика, од Монтгомери 2007). След работа потврдува дека различните варијанти на PfEMP1 имаат различни тропизми за различни ткива (Смит, 2014).
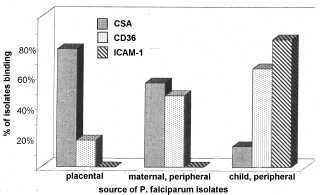
Слика, модифицирани од Beeson 1999 година покажува пропорциите на изолати кои се врзуваат на АДС, CD36, или ICAM-1. Заразени еритроцити беа собрани од плацентата, периферната циркулација на мајката или периферна циркулација на детето.
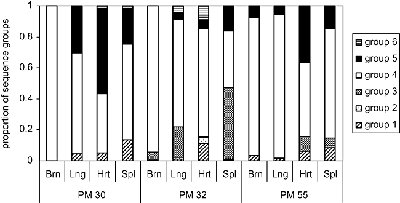
Слика, од Монтгомери 2007 година покажува процентот на различните видови на PfEMP1 (означени како групи 1-6) изразени во различни ткива (мозокот, белите дробови, срцето и слезината) од 3 различни пациенти. PM30 починал од тешка маларија анемија. PM32 е пациентки со церебрална маларија и тешка анемија. PM55 беше дијагностициран само со церебрална маларија.
Во поново време се покажа дека посебна подгрупа на var гени се високо транскрибирани по избор на човечкиот мозок ендотелните клетки и дека истите овие различни подтипови се поврзани со церебрална маларија (Aird 2014 година; Cunnington 2013 година; Смит 2013). Ова ткиво специфичен израз на одредени гени var подразбира дека различни ткива се изборот на различни паразит население врз основа на одредени PfEMP1 се изразени на површината на инфицираните еритроцити.
Иако секвестрација нуди многу предности за паразитот, изразот на антигени на површината на инфицираните еритроцити обезбедува цел за имунолошкиот систем на домаќинот. Паразитот се спротивставува на имунолошкиот одговор на домаќинот преку изразување на антигенски различни PfEMP1 молекули на површината на еритроцитите. Ова им овозможува на паразит да се избегне расчистување на имунолошкиот систем на домаќинот, но сепак задржи cytoadherent фенотип. Ова антигенски префрлување може да се појави како често што е 2% на годишно производство во отсуство на имунолошкиот притисок (Робертс 1992). Молекуларните механизми на антигенска префрлување не е позната. Експериментални докази покажуваат дека механизмот не е поврзан со дупло транспонирање во специфичен израз поврзани со веб-сајтови кои се наоѓаат во Африка trypanosomes. Само еден ген var се изразува во исто време (на пример, алелни исклучување). На не-изрази гени се молчеше од протеини кои се врзуваат на промотор регионот. Генот може да се активираат со репозиционирање на одредена локација во јадрото и е поврзан со хроматскиот модификација. Овој израз место можат да се сместат само еден активен ген промотор. Така промотор на var е доволно и за замолчување и моно-алелни транскрипција на PfEMP1 алел (Фос 2006 година; Guizetti 2013).
Резиме
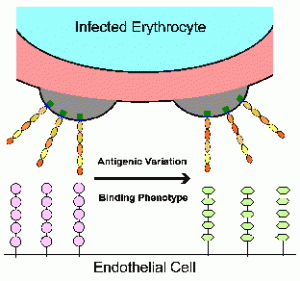 Паразитот на маларијата модифицира на еритроцитите, со извоз на протеини во клетката на домаќинот.
Паразитот на маларијата модифицира на еритроцитите, со извоз на протеини во клетката на домаќинот.
Една таква промена е израз на PfEMP1 на површината на еритроцитите кој функционира како cytoadherent лиганд.
Врзувањето на овој лиганд за рецепторите на клетките на домаќинот ендотелни промовира секвестрација и овозможува инфицираните еритроцити за да се избегне слезината.
Бројни PfEMP1 гени (на пример, ген семејство var) обезбеди паразит со средства за да се движат на антиген изразени на површината на еритроцитите.
Ова антигенски варијации, исто така, е во корелација со различни cytoadherent фенотипови.
РЕФЕРЕНЦИ
Адамс JH, Некој BKL, Долан СА, Фанг XD, Kaslow DC, Милер LH (1992) А семејството на еритроцитите врзувачки протеини од паразитите на маларија. Proc Natl Акад наука САД 89, 7085-7089.
Aird WC, Mosnier LO Fairhurst РМ (2014) Plasmodium falciparum зема (на) EPCR. Крв 123, 163-167.
Bannister LH, Мичел ГХ, Малиот Џорџија, Денис ЕД, Коен S (1986) Структура и развој на површински слој на еритроцитни мерозоити на Plasmodium knowlesi. Клеточно ткиво Res 245, 281-290.
Barale JC, Blisnick T, Fujioka H, Alzari премиер, Aikawa М, Браун бретонски C, Langsley G (1999) Plasmodium falciparum subtilisin како протеаза 2, кандидат на merozoite за merozoite површински протеин 1-42 maturase. Proc Natl Акад наука У S A 96, 6445-6450.
Beeson JG, Браун Г.В. (2002) Патогенеза на Plasmodium falciparum маларија: улогите на паразит адхезија и антигенски варијации. Ќелија. Мол. Животот Наука. 59, 258-271.
Beeson JG, Браун Г.В., Molyneux ME, Mhango C, Dzinjalamala F, Rogerson С.Ј. (1999) Plasmodium falciparum изолира од заразените бремени жени и деца се поврзани со различни лепило и антигенски својства. Ј зарази ДИС 180, 464-472.
Besteiro S, Dubremetz JF, Lebrun М (2011) се движат спој на apicomplexan паразити: клучен структура за инвазија. Мобилен Microbiol 13, 797-805.
Бигс БА, Андерс РФ, Дилан тој, Davern КМ, Мартин М, Петерсен C, Браун Г.В. (1992) Почитувањето на заразени еритроцити да venular ендотел избира за антигенски варијанти на Plasmodium falciparum. J Immunol 149, 2047-2054.
Blackman МП, Fujioka H, Стафорд WL, Sajid М, Clough Б, дупка SL, Aikawa М, М Grainger, Хакет F (1998) А subtilisin-како протеини во секреторни органели на Plasmodium falciparum мерозоити. J Biol Chem 273, 23.398-23.409.
Бојл МП, Лангер C, Чен ja, Hodder АН, Coppel РЛ, Андерс РФ, Beeson JG (2014) Последователно обработка на merozoite површински протеини за време и по еритроцитите инвазија од Plasmodium falciparum. Зарази Immun 82, 924-936.
Браун бретонски C, Переира да Силва LH (1993) маларија протеази и клеточната инвазија црвена крв. Parasitol Денес 9, 92-96.
Carruthers VB, Sibley LD (1997) Последователно лачење протеин од три различни органели на Toxoplasma gondii придружува инвазија на човековите фибробластите. Eur J Мобилен Biol 73, 114-123.
Claessens А, Хамилтон WL, Kekre М, Ото ТД, Faizullabhoy А, Rayner JC и Квјатковски Д (2014) генерација на антигенска разновидност во Plasmodium falciparum со структурирани преуредување на Var гени за време на митозата. PLoS Genetics 10 (12): e1004812.
Купер JA (1993) Merozoite површински антиген-1 на Plasmodium. Parasitol Денес 9, 50-54.
Кравар AF, Бери D, Баум J (2012) клеточна и молекуларна основа за маларија паразит инвазија на човечки црвени крвни клетки. J Мобилен Biol 198, 961,971.
Краб БС, Кук Б.М., Ридер JC, Waller РФ, Каруана СР, Davern КМ, Wickham ME, Браун Г.В., Coppel РЛ, кравар AF (1997) Насочени ген нарушување покажува дека рачки овозможи маларија инфицирани црвени крвни клетки да cytoadhere под физиолошки стрес на смолкнување . Мобилен 89, 287-296.
Крег А, Scherf А (2001) молекули на површината на Plasmodium falciparum инфекција на еритроцитите и нивната улога во патогенезата маларија и имунолошкиот затајување. Мол. Biochem. Parasitol. 115, 129-143.
Crosnier C, Бустаманте LY, Bartholdson С.Ј. et al (2011) Basingin е рецептор од суштинско значење за еритроцитите инвазија од Plasmodium falciparum. Природата 480, 534-537.
Cunnington AJ, Рајли ЕМ Валтер М (2013) Stuch во рутина? Преиспитување на улогата на врзување на паразитот во тешка синдроми маларија. Tr Parasitol 29, 585-592.
Deitsch KW, Дел Pinal А, Wellems ТЕ (1999) Внатрекластерските рекомбинација и var транскрипција прекинувачи во антигенски варијации на Plasmodium falciparum. Biochem Мол Parasitol 101, 107-116.
Deitsch KW, Wellems ТЕ (1996) Мембрана измени во еритроцитите инфицирани со Plasmodium falciparum. Biochem Мол Parasitol 76, 1-10.
Дафи МФ, Caragounis А, Noviyanti R, Kyriacou НВ, Choong EK, Бојсен К, исцелител Ј, Роу ja, Molyneux ME, Браун Г.В., Rogerson С.Ј. (2006) транскрибирани var гени поврзани со плацентата маларија во Малави жените. Зарази. Immun. 74: 4875-4883.
Гоел В.К., Ли X, Лиу Кометал, Chishti Ah, О С.С. (2003) Бенд 3 е домаќин рецептор обврзувачка merozoite површински протеин 1 за време на Plasmodium falciparum инвазија на еритроцитите. Proc Natl Акад наука 100, 5164-5169.
Gratzer СБ, Dluzewski AR (1993) на црвени крвни клетки и маларија паразит инвазија. Семин Hematol 30, 232-247.
Guizetti Ј, Scherf А (2013) Тишина, активирање, спокојство и да преминете! Механизми на антигенски варијации во Plasmodium falciparum. Мобилен Microbiol 15, 716-726.
Хан YS, Томпсон Ј, Kafatos ФК, Barillas-Mury C (2000) молекуларна интеракции помеѓу Anopheles stephensi midgut клетки и Plasmodium berghei: темпирана бомба теорија на ookinete инвазија на комарци. EMBO Ј 19, 6030-6040.
Држач за АА, Blackman МП, Borre М, Burghaus Па, Chappel ja, Кин К., Линг ИТ, Огун СА, Овен CA, Sinha КА (1994) паразитите на маларија и на еритроцитите инвазија. Biochem социјален Транс 22, 291-295.
Hviid L, Јенсен АТР (2015) PfEMP1 †“паразит Протеини семејство од клучно значење во Plasmodium falciparum маларија имунитет и патогенезата. Напредокот во паразитологија 88, 51-84.
Kappe ЗЗО, Buscaglia CA, Бергман LW, Coppens I, Nussenzweig V (2004) Apicomplexan плови мотилитет и клетката на домаќинот инвазија: реконструкција на моделот на моторот. Трендови во паразитологија 20, 13-16.
Leykauf К, Treeck М, Gilson односи со јавноста, Nebl T, Braulke T, кравар AF, Gilberger TW, Краб БС (2010) протеин киназа зависна фосфорилација на апикалната мембрана антиген 1 планови важна улога во еритроцитите инвазија од страна на паразитот на маларијата. PLOS Патогени 6, e1000941.
Мичел ГХ, Томас AW, Margos G, Dluzewski AR, Банистер LH (2004) апикалната мембрана антиген 1, една од главните кандидати маларија вакцина, посредува во близина прилог на инвазивни мерозоити да биде домаќин на црвените крвни зрнца. Зарази. Immun. 72, 154-158.
Монтгомери Ј, Mphande ФА, Berriman М, болка, Rogerson С.Ј., Тејлор ТЕ, Molyneux ME, Крег, (2007) Диференцијални var генската експресија во органите на пациенти умираат од falciparum маларија. Молекуларна микробиологија 65, 959-967.
Мота ММ, Pradel G, Vanderberg GP, Hafalla JCR, Frevert U, Nussenzweig РС, Nussenzweig V, Родригез А (2001) Миграција на Plasmodium спорозоити преку клетки пред инфекција. Наука 291, 141-144.
О СС, Фогт S, Фишер D, Ји С.Ј., Лероа PJ, Derick LH, Лиу Кометал, Chishti А. (2000) Plasmodium falciparum еритроцитни мембрански протеини 1 е укотвен на спектрин-актин куп и копчето-поврзани хистидин богата со протеини на еритроцитите цитоскелетонот . Biochem Мол Parasitol 108, 237-247.
Рид MB, Каруана СР, Batchelor Ah, Томпсон К., Краб БС, кравар AF (2000) Насочени нарушување на обврзувачки антиген на еритроцитите во Plasmodium falciparum е поврзан со прекинувач кон сиалична киселина, независна патека на инвазијата. Proc Natl Акад наука САД 97, 7509-7514.
Робертс диџеј, Крег АГ, Berendt AR, pinches R, G Неш, Марш К, Newbold CI (1992) Брзиот префрлување на повеќе антигенски и лепило фенотипови во маларија. Природата 357, 689-692.
Rottmann М, Lavstsen T, Mugasa ЈП, Kaestli М, Јенсен АТР, Милер D, T Theander, Бек HP (2006) диференцијални изразување на var ген групи е поврзан со морбидитетот од Plasmodium falciparum инфекција кај деца во Танзанија. Зарази. Immun. 74, 3904-3911.
Сем-Yellowe Тај (1996) Rhoptry органели на apicomplexa: нивната улога во клетката на домаќинот инвазија и интрацелуларен опстанок. Parasitol Денес 12, 308-316.
Сантос JM и Soldati-Favre Д (2011) Инвазија фактори се во комбинација на клучните настани сигнализација што доведува до формирање на инфекција во apicomplexan паразити. Мобилни Микробиологија 13, 787-796.
Scherf А, Хернандез-Rivas R, Вклучена P, Bottius Е, Benatar C, Pouvelle Б, Gysin Ј, Lanzer М (1998) антигенски варијации во маларија: in situ префрлување, опуштени и меѓусебно се исклучуваат транскрипција на var гени во рамките на еритроцитната развој во Plasmodium falciparum. EMBO Ј 17, 5418-5426.
Шарма P, Chitnis CE (2013) Клучни молекуларни настани за време на инвазијата на клетката домаќин од Apicomplexan патогени. Дет Opin Microbiol 16, 432-437.
Шерман IW, Crandall ИЕ, Гатри N, земјиште КМ (1995) Леплива тајните на секвестрација. Parasitol Денес 11, 378-384.
Шерман IW, Еда S, WINOGRAD Е (2003) Cytoadherence и врзување со Plasmodium falciparum: Дефинирање на врски кои ги поврзуваат. Бактерии и инфекции 5, 897-909.
Sinnis P, Некој BKL (1997) Мобилен инвазија од страна на фазите на ‘рбетниците на Plasmodium. Tr Microbiol 5, 52-58.
Смит JD (2014) Улогата на класификација адхезија домен PfEMP1 во Plasmodium falciparum патогенезата истражување. Biochem Мол Parasitol 195, 82-87.
Смит JD, Роу ja, Хигинс MK Lavstsen Т (2013) смртоносен стисок маларија е: cytoadhesion на Plasmodium falciparum инфицирани еритроцитите. Мобилен Microbiol 15, 1976-1983.
Tham WH, исцелител Ј, кравар AF (2012) еритроцити и ретикулоцити обврзувачки како протеини од Plasmodium falciparum. Tr Parasitol 28, 23-30.
Tomley FM, Soldati ДС (2001) Се меша и натпревар модули: структурата и функцијата на microneme протеини во apicomplexan паразити. Трендови Parasitol. 17, 81-88.
Тонкин ML, Roques М, Lamarque МЗ, Pugniere М, В Douguet D, Крафорд Ј, Lebrun М, Boulanger МЈ (2011) Домаќинот Мобилен инвазија од Apicomplexan паразити: Увид од ко-Структура на AMA1 со RON2 пептид. Наука 333, 463-467.
Тарнер GDH, Морисон H, Џонс М, Дејвис ТМЕ, Looareesuwan S, Buley проект, Gatter KC, Newbold CI, Pukritayakamee S, Nagachinta Б, бела Њу Џерси, Berendt AR (1994) Еден имунохистохемиска студија на патологијата на фатална маларија – доказ за широка активирање ендотелни и потенцијална улога за меѓуклеточната адхезивна молекула-1 во церебрална секвестрација. Am J Pathol 145, 1057-1069.
Вос TS, исцелител Ј, Марти AJ, Дафи МФ, Томпсон К., Beeson JG, Ридер JC, Краб БС, кравар AF (2006) А var контроли ген промотор алелни исклучување на вирулентни гени во Plasmodium falciparum маларија. Природа 439: 1004-1008.
Waller KL, Кук Б.М., Nunomura W, Махатма N, Coppel RL (1999) Мапирање на врзувачки домени вклучени во интеракцијата помеѓу Plasmodium falciparum копчето-поврзани хистидин богата со протеини (KAHRP) и cytoadherence лиганд P. falciparum еритроцитни мембрански протеин на 1 (PfEMP1). J Biol Chem 274, 23.808-23.813.
Waterkeyn JG, Wickham ME, Davern КМ, Кук Б.М., Coppel РЛ, Ридер JC, Culvenor JG, Waller РФ, кравар AF (2000) Наменет мутагеност на Plasmodium falciparum еритроцитни мембрански протеин 3 (PfEMP3) нарушува cytoadherence на маларија инфицирани црвени крвни клетки . EMBO Ј 19, 2813-2823.
Zieler H, Дворжак JA (2000) Инвазија ин витро на комарец midgut клетки со средствата на маларија паразит од страна на конзервирани механизам и резултира со смрт на нападна midgut клетки. Proc Natl Акад наука 97, 11.516-11.521.
Zilversmit ММ, Чејс EK, Чен ДС, Awadalla P, Денот на КП и McVean G (2013) хиперваријабилниот антиген гени во маларија има антички корени. БМК Еволутивна биологија 13: 110.
Zuccala ES и Баум J (2011) цитоскелетна и мембрана ремоделирање во маларија паразит инвазија на човечкото eythrocyte. Британскиот J Хематологија 154, 680-689